Faktor VIII SDH Intersero enthält sowohl Faktor VIII als auch signifikante Mengen des natürlichen Trägermoleküls von Willebrand-Faktor (VWF). Die Molekülstruktur von FVIII ist hochkomplex (240 kDa) und zeichnet sich durch ein sogenanntes Heterodimerenmuster aus (leichte und schwere FVIIIKette; über Metallionen komplexiert). Dieses Muster resultiert aus den verschiedenen Aktivierungs- (Proteolyse-)Prozessen im Faktor VIII-Lebenszyklus. Im Blutkreislauf zirkuliert Faktor VIII nicht frei, sondern gemeinsam mit dem Trägermolekül VWF. Der VWF ist ebenfalls ein hochkomplexes Molekül mit Molekulargewichten in einem Bereich zwischen 500 und 20.000 kDa. Dimere mit einem Grundgewicht von 500 kDa multimerisieren zu Komplexen mit einem Molekulargewicht bis zu 20.000 kDa. Die elektrophoretischen Auftrennungen der beiden Molekülkomplexe sind in den Abbildungen 2 und 3 gezeigt
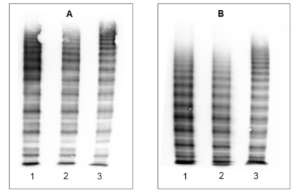
Die elektrophoretische Auftrennung der VWF-Multimeren zeigt zum einen, dass die VWF-Triplettstruktur von Normalplasma und Faktor VIII SDH Intersero identisch ist (keine Modifikationen durch das Herstellverfahren), zum anderen ist erkennbar, dass alle VWF-Multimeren vorhanden sind (große Multimeren vermindert).
Faktor VIII ist ein essentieller Kofaktor der Gerinnungskaskade, an deren Ende die Polymerisation von Fibrin steht. Sowohl in den FVIII-speichernden Zellen als auch in der Blutzirkulation liegt FVIII immer im Komplex mit dem VWF vor. In diesem FVIII-VWF-Zusammenspiel werden dem VWF vielfältige Funktionen zugeordnet [2-5]. Dazu zählen:
- Stabilisierung der Heterodimerenstruktur
- Schutz vor unspezifischer Aktivierung und Abbau
- Aufrechterhaltung einer definierten Konformation
- Reduktion der Immunogenität
Insbesondere die Punkte 3 und 4 sind von großer Bedeutung, da sie einen positiv-prognostischen Parameter im Hinblick auf die Inhibitorinduktion bei Patienten mit Hämophilie A darstellen können. Zahlreiche Studien bei zuvor unbehandelten Patienten mit schwerer Hämophilie A bestätigen, dass bestimmte VWF-haltige Präparate eine sehr niedrige Hemmkörperinzidenz aufweisen [6-8]. Interessant sind auch die Ergebnisse der sogenannten SIPPET-Studie, bei der gezeigt werden konnte, dass plasmatische Produkte mit VWF eine niedrigere Hemmkörperinzidenz aufweisen als rekombinante Produkte [9].
Referenzen
[1] Griffith, M. et al.: Inprocess controls and characterization of recombinate antihemophilic factor (recombinant). Ann. Hematol. 63: 166–171 (1991).
[2] Federici, A. B. : The factor VIII / von Willebrand factor complex: from physiopathology to clinical practice. Haematologica 86 (supplement 4): 6–15 (2001).
[3] Behrmann, M. et al.: Immunogenicity of plasma derived and recombinant FVIII product in Haemophilia A mice. Thromb.Hemost. 88: 221–229 (2001).
[4] Delignat, S. et al.: Comparison of the immunogenicity of different therapeutic preparations of human factor VIII in the murine model of hemophilia A. Haematologica 92:1426–1426 (2007).
[5] Dagupta, S. et al.: VWF protects FVIII from endocytosis by dendritic cells and subsequent presentation to immune effectors. Blood 109: 610–612 (2007).
[6] Yee, T. T. et al.: Absence of inhibitors in previously untreated patients with severe haemo-philia A after exposure to a single intermediate purity factor VIII product. Thromb Haemost. 78:1027–1029 (1997).
[7] Goudemand, J. et al.: Influence of the type of factor VIII concentrate on the incidence of factor VIII inhibitors in previously untreated patients with severe hemophilia A. Blood 107: 46–51 (2006).
[8] Gringeri, A. et al.: Occurence of inhibitors in previously untreated patients or minimally trea-ted patients with haemophilia A after exposure to a plasma-derived solvent-detergent factor VIII concentrate. Haemophilia 12: 128–132 (2006).
[9] Peyvandi, F. et al.: A Randomized Trial of Factor VIII and Neutralizing Antibodies in Hemophilia A. N Engl J Med 374: 2054-2064 (2016).
![Abb. 2: Elektrophoretische Auftrennung verschiedener Proben von Faktor VIII SDH Intersero (SDSPAGE 4-12%) und Detektion der FVIII-Banden mit polyklonalem FVIII-Antiserum vom Schaf im
Western Blot (Labor Dr. S. Lacroix-Desmazes, Paris).
Spuren 1 – 4: 0,1/0,2/0,3/0,4 IE FVIII:C. Molekulargewichtsstandard: Dual Color Biorad
Die elektrophoretische Auftrennung der FVIII-Polypeptide aus Faktor VIII SDH Intersero liefert ein
Bandenmuster, welches typisch für plasmatische FVIII-Produkte ist (siehe auch Griffith et al. [1]).](http://www.intersero.de/wp-content/uploads/2019/11/Herstellung_Faktor_VIII_SDH_Intersero_2-300x300.png)